Dopo oltre due decenni di ricerche è stato finalmente approvato in Europa il primo vaccino per l'immunizzazione attiva di individui di 18 anni e più a rischio di infezione da virus Ebola. La decisione è stata presa dalla Commissione europea appena un mese dopo aver ricevuto il parere positivo dei propri esteri. Frutto della ricerca di MSD, sarà messo in commercio con il marchio Ervebo (rVSVΔG-ZEBOV-GP).
"L'autorizzazione all'immissione in commercio di Ervebo da parte della Commissione Europea è il risultato di una collaborazione senza precedenti di cui il mondo intero dovrebbe essere orgoglioso", ha dichiarato
Ken Frazier, presidente e amministratore delegato di MSD. "È una pietra miliare storica e una testimonianza del potere della scienza, dell'innovazione e del partenariato pubblico-privato", ha aggiunto Frazier, precisando che l'azienda lavorerà con la Food and Drug Administration negli Stati Uniti e le agenzie di regolatorie in un certo numero di paesi africani per ottenere la licenza del vaccino.

pharmastar.it
AbbVie, nasceranno in Italia i nuovi farmaci per le malattie autoimmuni
Mercoledi 6 Novembre 2019 Redazione

AbbVie, azienda biofarmaceutica globale basata sulla ricerca, continua a investire sulla produzione: 130 milioni di euro investiti in Italia negli ultimi anni, nuove linee produttive e un ampliamento dell’impianto chimico, un sito industriale sempre più ‘green’. Nello stabilimento a sud di Roma si producono farmaci innovativi a supporto di diverse aree terapeutiche, tra cui i nuovi farmaci per il trattamento di patologie croniche autoimmuni, come artrite reumatoide e psoriasi.
La farmaceutica in Italia rappresenta un asset importante dell’economia e può contribuire in maniera determinante alla crescita del nostro paese oltre che alla salute delle persone.

pharmastar.it
Tubercolosi, risultati positivi con nuovo vaccino sperimentale di GSK. Potrebbe evitare milioni di decessi
Venerdi 1 Novembre 2019 Davide Cavaleri

Un gruppo di sperimentatori di GlaxoSmithKline ha completato l'analisi di uno studio di fase IIb per quello che ritengono possa essere il primo grande passo avanti nel campo dei vaccini contro la tubercolosi in circa 100 anni, la più letale patologia infettiva che provoca oltre 1,5 milioni di morti all'anno in tutto il mondo. I risultati del trial sono stati pubblicati sul prestigioso New England Journal of Medicine.
aboutpharma.com
Manovra, Aifa riaccende il dibattito sui farmaci biosimilari
Fra i suggerimenti inviati dall’agenzia regolatoria al ministero della Salute, l’introduzione della sostituibilità automatica. Assobiotec: “Proposta irricevibile”. Italian biosimilars group: “Rischio boomerang”
di Redazione Aboutpharma Online 18 ottobre 2019

L’Agenzia italiana del farmaco riaccende il dibattito sui biosimilari. Lo fa con una proposta rivolta al ministero della Salute, in vista della legge di Bilancio, per introdurre la sostituibilità automatica tra farmaco biologico di riferimento e un suo biosimilare. La richiesta è contenuta in un documento – trasmesso da via del Tritone il 26 settembre e anticipato nei giorni scorsi da QuotidianoSanità – dove l’Aifa suggerisce nero su bianco una serie di emendamenti per un totale di quattro interventi in materia di farmacia.

askanews.it
Alleati per la Salute: un progetto digitale contro le fake news
L'iniziativa di Novartis insieme alle associazioni dei pazienti
Martedì 15 ottobre 2019 - 10:22

Milano, 15 ott. (askanews) – Vincere la sfida sempre più insidiosa delle fake news nella salute, fenomeno esploso con l’enorme diffusione della comunicazione digitale, sfruttando proprio le infinite potenzialità delle tecnologie digitali. Questo l’ambizioso obiettivo che si pongono le associazioni di pazienti italiane, da raggiungere attraverso un’innovativa piattaforma digital, che sarà implementata e sostenuta da Novartis, in grado di veicolare informazioni medico scientifiche autorevoli e ‘certificate’.
.gif)
adnkronos.com/salute
Il genetista, 'farmaco su misura solo un primo successo'
Fda ha contravvenuto a sue regole e, per un caso positivo, non conosceremo tutti quelli negativi
 FARMACEUTICA Pubblicato il: 15/10/2019 21:42
FARMACEUTICA Pubblicato il: 15/10/2019 21:42
"Il punto fondamentale che rende questo caso dirompente è il fatto che un ente regolatorio come la Food and Drug Administration (Fda) abbia autorizzato il trattamento di un singolo paziente, nonostante non siano stati prodotti i dati di sicurezza del trattamento usualmente richiesti, anche se lo stesso approccio terapeutico si era dimostrato efficace per l'atrofia muscolare spinale. Questa prima approvazione aprirà la porta a una vera e propria rivoluzione, che però ci dovrà fare alzare la guardia sui possibili effetti tossici dei trattamenti. E' ragionevole pensare che per uno che funziona (ed è stato infatti pubblicato su Nejm), altri falliranno". A commentare con l'Adnkronos Salute il caso del milasen, primo farmaco 'su misura' per una sola paziente, è Francesco Danilo Tiziano, professore associato all'Istituto di Medicina genomica dell'Università Cattolica del sacro cuore di Roma.

pharmastar.it
Ranitidina, GSK interrompe la distribuzione e ritira il prodotto dal mercato
Sabato 12 Ottobre 2019 Davide Cavaleri

Dopo l’avvertimento della Fda statunitense sulla presenza di una sostanza nociva all’interno dei medicinali a base di ranitidina, GlaxoSmithKline ha deciso seguire l’esempio delle altre case farmaceutiche coinvolte, interrompendo la distribuzione del prodotto e predisponendone il ritiro dagli scaffali delle farmacie.
Nei giorni scorsi l'agenzia regolatoria britannica per i medicinali e i prodotti sanitari ha comunicato che la multinazionale ha informato che sta richiamando tutte le confezioni di
ranitidina dai punti vendita «a causa di una possibile contaminazione con un'impurità, la N-nitrosodimetilammina (NDMA), che ha un potenziale genotossico e cancerogeno».
adnkronos.com
I grossisti, la carenza dei farmaci è un fenomeno europeo
 FARMACEUTICA Pubblicato il: 30/08/2019 12:22
FARMACEUTICA Pubblicato il: 30/08/2019 12:22 
"L'Italia è un paese produttore ed esportatore di farmaci e quindi anche i grossisti possono legittimamente esportare, qualora non vi sia uno specifico provvedimento. Ma le industrie per alcuni prodotti tagliano anche dell'80% gli ordini dei grossisti", che ne ricevono meno di quelli richiesti. "Ecco come si arriva alla carenza sul territorio". A evidenziarlo è il presidente di Adf (Associazione Distributori Farmaceutici), Alessandro Morra, tornando sul tema delle carenze di medicinali.
pharmastar.it
Oncologia, via libera dell'Fda per il farmaco agnostico entrectinib che ottiene la doppia indicazione per NTRK e ROS1
Martedi 27 Agosto 2019 Redazione
L'Fda ha approvato entrectinib per il trattamento di adulti con tumore del polmone non a piccole cellule ROS1-positivo e metastatico. Inoltre, entrectinib ha ottenuto l'approvazione accelerata per il trattamento di tumori solidi che hanno una fusione genica del recettore della tirosina chinasi (NTRK). Sviluppato da Roche, il farmaco sarà messo in commercio con il marchio Rozlytrek. Appartiene alla stessa classe di larotrectinib di Bayer approvato negli Usa lo scorso novembre.

L’Fda ha approvato entrectinib per il trattamento di adulti con tumore del polmone non a piccole cellule ROS1-positivo e metastatico. Inoltre, entrectinib ha ottenuto l'approvazione accelerata per il trattamento di tumori solidi che hanno una fusione genica del recettore della tirosina chinasi (NTRK) senza una nota mutazione di resistenza acquisita, sono metastatici o in cui la resezione chirurgica può portare a grave morbilità, e sono andati in progressione dopo il trattamento o non hanno una terapia alternativa soddisfacente.
Sviluppato da Roche, il farmaco sarà messo in commercio con il marchio Rozlytrek.

ansa.it
Arriva la tassa sulle sperimentazioni animali, scienziati insorgono
Decreto del ministero della Salute introduce tariffe per le autorizzazioni
.png)
quotidianosanita.it
Car-T: pronto il primo accordo per le nuove terapie. Si pagherà in base ai risultati effettivi. Martini (Ex Dg Aifa): “Un nuovo modello di negoziazione che pone l’Italia all’avanguardia”
Approvato dal Cpr e Cts di Aifa il primo accordo (con la Novartis) per le terapie che permettono di riprogrammare alcune cellule del paziente (i linfociti T appunto), in modo da renderle capaci, una volta reinfuse, di riconoscere e bersagliare i tumori. Ora l’accordo dovrà essere ratificato dal Cda Aifa e poi pubblicato in Gazzetta Ufficiale. Ne abbiamo parlato con l’ex Dg Aifa Nello Martini.
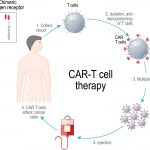
04 AGO - Pronto l’accordo tra Aifa e Novartis per le nuove terapie Car-T. Un accordo innovativo, tutto basato sul modello del payment by result e che può rappresentare certamente un riferimento anche a livello europeo.
La nuova terapia denominata tisagenlecleucel (Kymriah) potrà essere disposta per pazienti pediatrici e giovani adulti fino a 25 anni di età con leucemia linfoblastica acuta (LLA) a cellule B che è refrattaria, in recidiva post-trapianto o in seconda o ulteriore recidiva e per pazienti adulti con linfoma diffuso a grandi cellule B (DLBCL) in recidiva o refrattario dopo due o più linee di terapia sistemica.

pharmastar.it
Accordo Pfizer e Mylan, nasce un gigante nei farmaci generici e biosimilari
Lunedi 29 Luglio 2019 Danilo Magliano
 E’ nata una nuova raltà leader al mondo nel settore dei farmaci a brevetto scaduto, generici e biosimilari. Sarà costituita dall’unione del business dei farmaci a brevetto scaduto di Pfizer con l’azienda farmaceutica Mylan.
E’ nata una nuova raltà leader al mondo nel settore dei farmaci a brevetto scaduto, generici e biosimilari. Sarà costituita dall’unione del business dei farmaci a brevetto scaduto di Pfizer con l’azienda farmaceutica Mylan.
La maggioranza (57 per cento) della nuova società sarà di proprietà di Pfizer, il restante 43 per cento degli attuali azionisti di Mylan. Pfizer riceverà anche una somma vicino a $12bn come contropartita del debito di Mylan che confluirà nella nuova entità.

pharmastar.it
Zambon si rafforza nelle malattie rare e acquisice la biotech Breath Therapeutics, affare del valore potenziale di €500 mln
Venerdi 26 Luglio 2019 Redazione

La casa farmaceutica italiana Zambon ha acquistato Breath Therapeutics, una società biotech privata fondata nel 2016 che ha sviluppato una piattaforma per la somministrazione personalizzata di farmaci per via inalatoria. L’accordo, se tutte le milestones andranno a buon fine, ha un valore massimo di 500 milioni di euro, ovvero circa 558,7 milioni di dollari.
L'acquisizione, che prevede un pagamento anticipato di 140 milioni di euro, include il candidato terapeutico principale di Breath, L-CsA-i, una nuova formulazione della ciclosporina A. Il farmaco immunosoppressivo è attualmente allo studio in due trial di fase 3 per la sindrome della bronchiolite obliterante.
.gif)
aboutpharma.com
Sanità e Politica
Avastin-Lucentis, Giulia Grillo: “Quantificheremo il danno e chiederemo il risarcimento”
Il ministro della Salute ha lasciato un videomessaggio sul suo profilo Facebook annunciando una serie di provvedimenti per possibili indennizzi al Ssn

“Quantificheremo il danno e chiederemo il risarcimento”. In soldoni è questo il messaggio che Giulia Grillo ha rilasciato con un videomessaggio sulla sua pagina di Facebook. “La sentenza del Consiglio di Stato ha messo la parola fine sul caso Avastin-Lucentis, respingendo definitivamente i ricorsi delle aziende e confermando sanzioni per circa 180 milioni alle case farmaceutiche coinvolte. Vi terrò aggiornati sulle prossime azioni che metteremo in campo per consentire al Servizio sanitario di avere il giusto risarcimento per il danno economico subito”.

ansa.it
Farmaci: gare al ribasso e fuga delle aziende dai medicinali più vecchi
Per i generici più ricavi, ma non compensano i costi